仪器分析计算题库
电化学计算题
1、25℃时用pH玻璃电极测定 pH=5的溶液,其电极电位+0.0435v;测定未知溶液时,电极电位则为0.0145v,计算未知液的pH值。
解:
2、取2.000g镉矿样,溶解后定量转移至250mL容量瓶中。吸取25mL进行极谱测定,测得其极谱波高为25.5mm。然后在此溶液中加入5mL5.0×10-4mol.L-1的镉标准溶液,测得极谱波高为30.4mm。计算矿样中镉的质量分数。
3、用钙离子选择性电极和SCE置于100mLCa2+试液中,测得电位为0.415V。加入2mL浓度为0.218mol/L的Ca2+标准溶液后,测得电位为0.430V。计算试液中Ca2+的浓度。
0.430={K+0.0592/2lg(2*0.218*64*10¯������³������
+100*C)}/102,K=?0.415=K+0.0592/2*lg(C),C=?
4、25℃时,电池:“镁离子电极│Mg2+(a=1.8╳10-3mol.L-1)‖饱和甘汞电极”的电动势为0.411V,用含Mg2+试液代替已知溶液,测得电动势为0.439V,试求试液中的pMg值。
解:∵E2- E1=(0.0592/2)pMg+(0.0592/2)lg(1.8×10-3) 0.439-0.411=(0.0592/2)pMg-0.0813
∴ pMg=3.69
5、25℃时,电池:“NO3-离子电极│NO3-(a=6.87╳10-3mol.L-1)‖饱和甘汞电极”的电动势为0.3674V,用含NO3-试液代替已知浓度的NO3-溶液,测得电动势为0.4464V,试求试液中的pNO3值。
解:∵E2- E1=0.4464--0.3674=-0.0592 pNO3-0.0592lg(6.87×10-3) 0.079=-0.0592 pNO3+0.128 ∴pNO3=0.828
6、在0.1000mol/L Fe2+溶液中,插入Pt电极(+)和SCE(-),在25℃时测得电池电动势为0.395V,问有多少Fe2+被氧化成Fe3+?
解: SCE‖a(Fe3+), a(Fe2+)|Pt
E = ��������铂电极- ��������甘汞 = 0.77 + 0.059 lg([Fe3+]/[Fe2+])-0.2438 lg([Fe3+]/[Fe2+
]) = (0.395+0.243-0.771) / 0.059 = -2.254
设有X % 的 Fe2+ 氧化为 Fe3+,则:
lg([Fe3+]/[Fe2+]) = lg X /(1-X)=-2.254 X/(1-X)=0.00557;
X=0.557%;
即有约0.56%的Fe2+被氧化为Fe3+
7、将钙离子选择电极和饱和甘汞电极插入100.00mL水样中,用直接电位法测定水样中的Ca2+ 。25℃时,测得钙离子电极电位为-0.0619V(对SCE),加入0.0731mol/L的Ca(NO3)2标准溶液1.00mL,搅拌平衡后,测得钙离子电极电位为-0.0483V(对SCE)。试计算原水样中Ca2+的浓度?
解:由标准加入法计算公式
S=0.059/2
Δc=(Vs cs)/Vo=1.00×0.0731/100
ΔE=-0.0483-(-0.0619)=0.0619-0.0483=0.0136 V cx=Δc(10ΔE/s-1)-1=7.31×10-4(100.461-1)-1 =7.31×10-4× 0.529=3.87× 10-4 mol/L
试样中Ca2+ 的浓度为3.87×10-4mol/L。


8、已知苯巴比妥与吡啶铜在0.1 mol/L的H2SO4溶液中可形成络合物,该溶液中络合物在-1780 mV处产生一个灵敏的极谱波。测定苯巴比妥药片中苯巴比妥的含量时,将20片药品研细混匀后处理为澄清水溶液100mL,分别准确移取10mL溶液于两个100mL容量瓶中(记为1号瓶与2号瓶),再向2号瓶中加入2.4g/L苯巴比妥标准溶液10mL,将1、2号瓶在相同条件下与吡啶铜络合,测定络合物极谱波,实验测得1号瓶波高为50µ������A,2号瓶波高为90µ������A。试计算每片药品中苯巴比妥的含量。
参考答案:根据h=KC
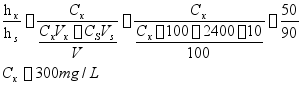
每片药片中苯巴比妥的含量=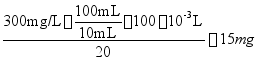
9、25℃时,用氯离子选择性电极测定含盐番茄汁中的CL-含量,取10mL番茄汁测得其电动势为-17.2mV,若向期中加入0.100mL 0.100mol/L的NaCl溶液,再测电动势为-35.5mV,计算每升番茄汁中所含CL-的毫克数。
解:根据电位分析法标准加入法公式,
![]()
![]()
![]()
9.73*10-4mol/L*35.5g/L=0.0345g/L=34.5mg/L
10、用极谱法测定MgCl2溶液中得微量Cd2+,取待测试液5.0mL,加入0.04%明胶5.0mL,用水稀释至50mL,通N2 10min后记录极谱图,得波高50uA。另取试液5.0mL,加入0.5mg/mlCd2+标准溶液1.0mL,混合均匀后,加入0.04%明胶5.0mL,用水稀释至50mL,通N2 10min后记录极谱图,得波高90uA。计算试样中Cd2+得含量。
解:根据极谱法扩散电流公式id=kc
得到以下方程组:50=kcx*5.0/50
90=k(cx*5.0+0.5*1.0)/50
解得试样中得Cd2+含量为Cx=0.125mg/mL
光学计算题
1、现测定铅时,0.1μg/ml铅的标准溶液产生吸光度为0.24,检测限为多少?空白测定20次的标准偏差0.012。
解:
2、某亚铁螯合物的摩尔吸收系数为 1.20×104L/(moL·cm),若采用 2.00cm 的吸收池,欲把吸光度限制在 0.200 至 0.650 之间,请计算该螯合物的浓度范围是多少?
3、已知某Cu2+溶液浓度为0.500g/L,吸收池厚度为1cm,其吸光度值A为0.536,求摩尔吸收系数。(MCu =63.5)
4、原子吸收法测定某试样溶液中的Pb, 用空气-乙炔焰测得Pb283.3nm和Pb281.7nm的吸收分别为72.5%和52.0%, 试计算(1)其吸光度(A)各为多少?(2)其透光度各为多少?
5、取2.00mL尿样,用试剂处理使其中的磷酸盐显色,并将处理液最后冲稀至100mL,取该溶液25.0mL,测得吸光度为0.428,另取25.0mL相同的溶液,并加入1.00mL含0.0500mg的磷酸盐标准溶液,测其吸光度为0.517。计算尿样中磷酸盐的含量(以mg/mL表示)
6、分别取浓度为0.001mol/L的Fe标准溶液1.00、2.00、3.00、4.00、5.00、6.00mL于50mL容量瓶中,加显色剂定容,测量其吸光度分别为:0.097、0.200、0.304、0.408、0.510、0.618。测定某一试样中Fe含量时,吸取试样液5.00mL,稀释至250.0mL,再取该稀释溶液
2.00mL置于50mL容量瓶中,与标准溶液相同条件显色定容,测得其吸光度为0.450,以校准曲线法作图并计算试样中Fe的浓度(以mol/L表示)。
7、测定血浆试样中锂的含量,将三份0.500mL血浆试样分别加至5.00mL水中,然后在这三份溶液中加入(1) 0μL, (2) 10.0μL, (3) 20.0μL 0.0500mol.L-1LiCl标准溶液,在原子吸收分光光度计上测得读数依次为(1) 0.230, (2) 0.453, (3) 0.680. 计算此血浆中锂的浓度。
8、NO2-离子在355nm处摩尔吸收系数��������355=23.3 L/(moL·cm),在355nm处和302nm处的摩尔吸收系数比值为,�������� 355/�������� 302=2.50,NO3-离子在355nm处吸收可以忽略,在波长302nm处摩尔吸收系数�������� 302=7.24 L/(moL·cm)。今有一含NO2-和NO3-离子的试液,用1.00cm 吸收池测得302nm处吸光度为A302=1.010和355nm处的吸光度为A355=0.730。计算试液中NO2-和NO3-的浓度?
9、已知维生素C的E 1% 1cm245nm=560.现称取维生素C 0.0512溶于 100ml的0.005mol/L硫酸溶液中,再准确量取此溶液2.0ml,稀释至100ml取此溶液于1cm吸收池中,在入max245nm处测得A值为0.5546,求样品中维生素C的百分含量.
10.精密称取维生素B12 0.00523g,置50ml量瓶中,加水溶解并稀释至刻度,摇匀.精密移取10ml,置另一50ml量瓶中,用水稀释至刻度,摇匀.用分光光度法于36lnm处测得吸收度为0.4350,求其百分含量?(维生素B12的百分吸光系数=207).
11、准确称取试样0.5000g,消化后定容成100.0mL。分取10.00mL试液,用原子吸收法测定锌的浓度,得数据如下表所示。
加入标准(μg/mL) 0(试样) 2.00
吸光度值 0.124 0.180
加入标准溶液体积可忽略不计,则试样中锌的含量是多少?(用μg·g-1表示) K=0.180/2.00=0.090, C=0.124/0.090= 1.378,CV/M*100%=0.03%
12、在原子吸收分析法中,蒸馏水调零后,用3.00微克/毫升的锌标准溶液测得吸光度为0.357。测得样品的吸光度为0.284。
⑴计算样品中钙的浓度为多少?
⑵若此试液由0.1088克固体样品消化定容成50.00mL而得,求该样品中锌的含量(mg/kg)。
解:∵A=KC ∴0.357=3.00K 0.284= KC C=2.39ug/ml
该样品中锌的含量为:50′2.39′10-3/0.1088=1.098mg/g=1098mg/kg
13、K2CrO4的碱性溶液在372nm处有最大吸收,若碱性K2CrO4溶液的浓度c(K2CrO4)=3.00╳10-5mol.L-1,吸收池长度为1cm,在此波长下测得透射比是71.6%。计算:⑴该溶液的吸光度;⑵摩尔吸收系数;⑶若吸收池长度为3cm,则透射比多大?
解:(1)A=-lgT=-lg71.6%=0.415(2)K=A/(CL)=0.415/(3.00×10-5×1)=4.83×103 (L·mol-1·cm-1 )(3)∵lgT=-A=-KCL=-4.83×103×3.00×10-5×3=-0.4347∴T=36.75%
14、苯胺在λmax为280nm处的k为1430L.mol-1.cm-1,现欲制备一苯胺水溶液,使其透射比为30%,吸收池长度为1cm,问制备100mL该溶液需苯胺多少克?
解:设需苯胺X g,则
∵A=-lgT= KCL
∴0.523=1430×(X/M×100×10-3) ×1
X=3.4×10-3g
15、精密称取KMnO4样品和KMnO4纯品各0. 1500g,分别溶于纯化水中并稀释至1000 mL。再各取10ml用纯化水稀释至50ml,摇匀,用1cm的吸收池,在525nm 处,测得样品溶液和标准溶液的吸光度分别为0.310和0.325。求样品中KMnO4的含量
16、用双硫腙萃取光度法测定样品中得含铜量,准确称取试样0.200g,溶解后定容至100mL,从中移取10mL显色并定容至25mL。用等体积得氯仿萃取一次,设萃取率为90%,有机相在最大吸收波长处用1cm比色皿测得其吸光度为0.40.已知双硫腙铜配合物在该波长下得摩尔吸收系数为4.0×104,铜得原子量为63.55.试计算试样中铜得质量百分数。
解:氯仿溶液中铜得浓度为
C=A/bε=0.40/(1×4.0×104)mol/L=1.0×10-5mol/L
等体积萃取,且萃取率为90%。那么定容为25mL体积内水相中铜得浓度为:
C=c/0.90=1.0×10-5mol/L/0.90=1.1×10-5mol/L
显色时将试样处理成100mL,从中移取了10mL显色定容至25mL,因此原试液中铜得浓度为C=1.1×10-5×25/10 =2.75×10-5 mol/L
故样品中铜得质量百分数为w=m/ms×100%=(cVMCu/ms)×100%
=(2.75×10-5 ×100×10-3×63.55/0.200)×100%=0.087%
色谱分析计算题
 1、在一根有效塔板数为10000的色谱柱上,两组分的相对保留值为1.02。(提示:考虑
1、在一根有效塔板数为10000的色谱柱上,两组分的相对保留值为1.02。(提示:考虑 ![]() )求:
)求:
(1)两组分的分离度;
(2)欲使分离度达到1.5,需要的有效塔板数。
2、用15cm长的ODS柱分离两个组分,柱效能n=2.85*104测得t0=1.31min,组分的tR1=4.10min;tR2=4.45min。求(1)k1,k2,α,R值(2)若增加柱长至30cm,分离度R可达到1.5?

3、已知甲、乙两化合物的HPLC的参数:t0=0.38min; tR1=11.25min 、w1=1.10min; tR2=14.67min、 w2=1.12min; 试求下列参数n2、k2、tR2′��������及分离度R1.2.
高效液相色谱法测定某复方片剂中A和B的含量,采用内标对比法定量。精密称取片剂粉末0.5010g(ms),加入内标物C的质量为0.0350g,经适当处理制备成100mL溶液(样品溶液);另精密称取A和B的对照品分别为0.2212g和0.1501g,加入内标物C为0.0350g,同上制成对照品溶液。该片剂的规格为每片含A0.22g(SA)、含B0.15g(SB),测得平均片重P=0.5012g。经测定,对照品溶液各组分的峰面积(μV·s)均值为:A(154900)、C(171200)、B(692300);样品溶液各组分的峰面积均值为:A(178000)、C(202700)、B(820900)。
计算:(1)M片剂中A,B的标识量(%)(2)M片剂中A,B的含量
4、在一色谱柱上,组分A流出需15.0min,组分B流出需25.0min,不被固定相滞留的组分C流出需2.0min。
求:
5、在一根3米长的色谱柱上分离一个试样的结果如下:死时间为1min,组分1的保留时间为14 min,峰宽0.8 min。组分2的保留时间为17 min,峰宽为1 min。试求:
1. 用组分2计算色谱柱的理论塔板高度H;
2. 求调整保留时间tR1及tR2
3用组分2求有效塔板数和有效塔板理论高度
4求容量因子k1及k2。
5.求相对保留值r21和分离度R?
6、已知试样中仅含有苯酚、邻甲酚和间甲酚三组分,用色谱法进行测定。色谱图中各组分色谱峰的峰高、半峰宽和各组分的校正因子分别如下。求各组分的百分含量
苯酚 邻甲酚 间甲酚 峰高/mm 64.0 104.1 70.0 半峰宽/mm 1.94 2.40 3.22 校正因子f
0.85
0.95
1.00
解:w1= A1f1/(A1f1+ A2f2+A3f3)
=64.0×1.94×0.85/(64.0×1.94×0.85+104.1×2.40×0.95+70.0×3.22×
1.00)=18.57%
同理:w2=41.77% w3=39.66%
7、在一根3.60米长的色谱柱上,某组分的调整保留时间为15分钟,峰宽为60秒(半峰宽为35.3秒),以此组分为标准,计算该柱的有效塔板数和有效板高。
n=16(15/10)²������=3600,H=L/n=3.6/3600= 0.001m
下列数据是由气-液色谱在一根40cm长的填充柱上得到的:
化合物tR/min Y/min
空气2.5 -
甲基环己烷,A 10.7 1.3
甲基环己烯,B 11.61.4
甲苯,C 14.0 1.8
求:⑴平均的理论塔板数;
⑵平均塔板高度;
⑶甲基环己烯与甲基环己烷的分离度;
⑷甲苯与甲基环己烯的分离度。
解:(1) ��������n=(n1+n2+n3)/3=��������16��������(10.7/1.3)2+16��������(11.6/1.4)2+16��������(14.0/1.8)2
��������/3 =1050
(2) ��������H=L/��������n=40/1050=0.038㎝
(3) RAB=(tR(B)��������tR(A))/[1/2(YA+YB)]=(11.6-10.7)/[1/2(1.3+1.4)]=0.67
(4) RCB=(tR(C)��������tR(B))/[1/2(YB+YC)]=(14.0-11.6)/[1/2(1.4+1.8)]=1.50
8、有一A、B、C三组分的混合物,经色谱分离后其保留时间分别为:
tR(A)=4.5min,tR(B)=7.5min,tR(C)=10.4min,tM=1.4min。
求⑴B对A的相对保留值; ⑵ C对B的相对保留值;
⑶B组分在此柱中的容量因子是多少?
解:(1) ��������B,A=t��������R(B)/ t��������R(A)= (7.5-1.4)/(4.5-1.4)=1.97
(2) ��������C,B=t��������R(C)/ t��������R(B)= (10.4-1.4)/(7.5-1.4)=1.48
(3) k��������B= t��������R(B)/tM=(7.5-1.4)/1.4=4.36
9、已知在混合酚试样中仅含有苯酚、o-甲酚、m-甲酚p-甲酚四种组
分,经乙酰化处理后,测得色谱图,从图上测得各组分的峰高、半峰宽以及测
得相对校正因子分别如下: 化合物 苯酚 O-甲酚 m-甲酚 p-甲酚
峰高/mm 64.0 104.1 89.2 70.0
半峰宽/mm 1.94 2.40 2.853.22
相对校正因子(f)0.85 0.951.031.00
求各组分的质量分数。
解:w1= A1f1/(A1f1+ A2f2+A3f3+A4f4)
=64.0×1.94×0.85/(64.0×1.94×0.85+104.1
×2.40×0.95+89.2×2.85×1.03+70.0×3.22×1.00)=105.54/830.13=12.72%
同理:w2=237.35/830.13=28.59%
w3=261.85/830.13=31.54%
w4=225.40/830.13=27.15%
10、有一A、B两组分的混合物,在1米长的色谱柱上经色谱分离后其保留时间分别为:
tR(A)=4.5min,tR(B)=7.5min,tM=0.8min。A、B组分的 峰宽分别为0.8 min,1 min,。试求:
1. 用组分B计算色谱柱的理论塔板数和理论塔板高度;
2. 求调整保留时间tRA及tRB
3. 若需达到分离度为1.5,所需最短柱长为几米?
参考答案:(1)
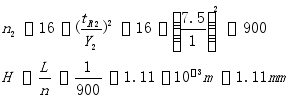
(2)
(3)
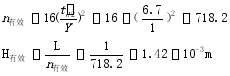
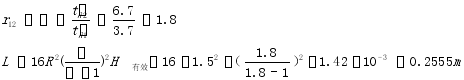
或者:相对保留值 a = t’R2/t’R1=3.7/6.7=0.552
根据公式:L=16R2[(0.552/(0.552-1)]2 H
11、有一试样含甲酸、乙酸、丙酸及不少水、苯等物质,称取此试样1.055g。以环己酮作内标,称取环己酮0.1907g,加到试样中,混合均匀后,吸取此试液3mL进样,得到色谱图。从色谱图上测得各组分峰面积及已知的S’值如下表所示:。
| 甲酸 | 乙酸 | 环己酮 | 丙酸 |
保留时间 峰底宽度 峰面积 响应值S’ | 3.8 0.78 14.8 0.261 | 5.6 0.82 72.6 0.562 | 7.1 0.87 133 1.00 | 8.4 0.84 42.4 0.938 |
计算:
(1)丙酸的色谱柱的理论塔板数n;
(2)甲酸与乙酸的分离度;
(3)计算甲酸、乙酸、丙酸的质量分数
解:(1)![]()
(2)![]()
(3)
根据公式: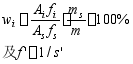
求得各组分的校正因子分别为:3.831;1.779; 1.00;1.07
代入质量分数的表达式中得到各组分的质量分数分别为:
w甲酸=(14.8/133)×(0.1907/1.055) ×3.831 ×100% = 7.71%
w乙酸 = (72.6/133) ×(0.1907/1.055) ×1.779 ×100% = 17.55%
w丙酸=(42.4/133) ×(0.1907/1.055) ×1.07 ×100% = 6.17%